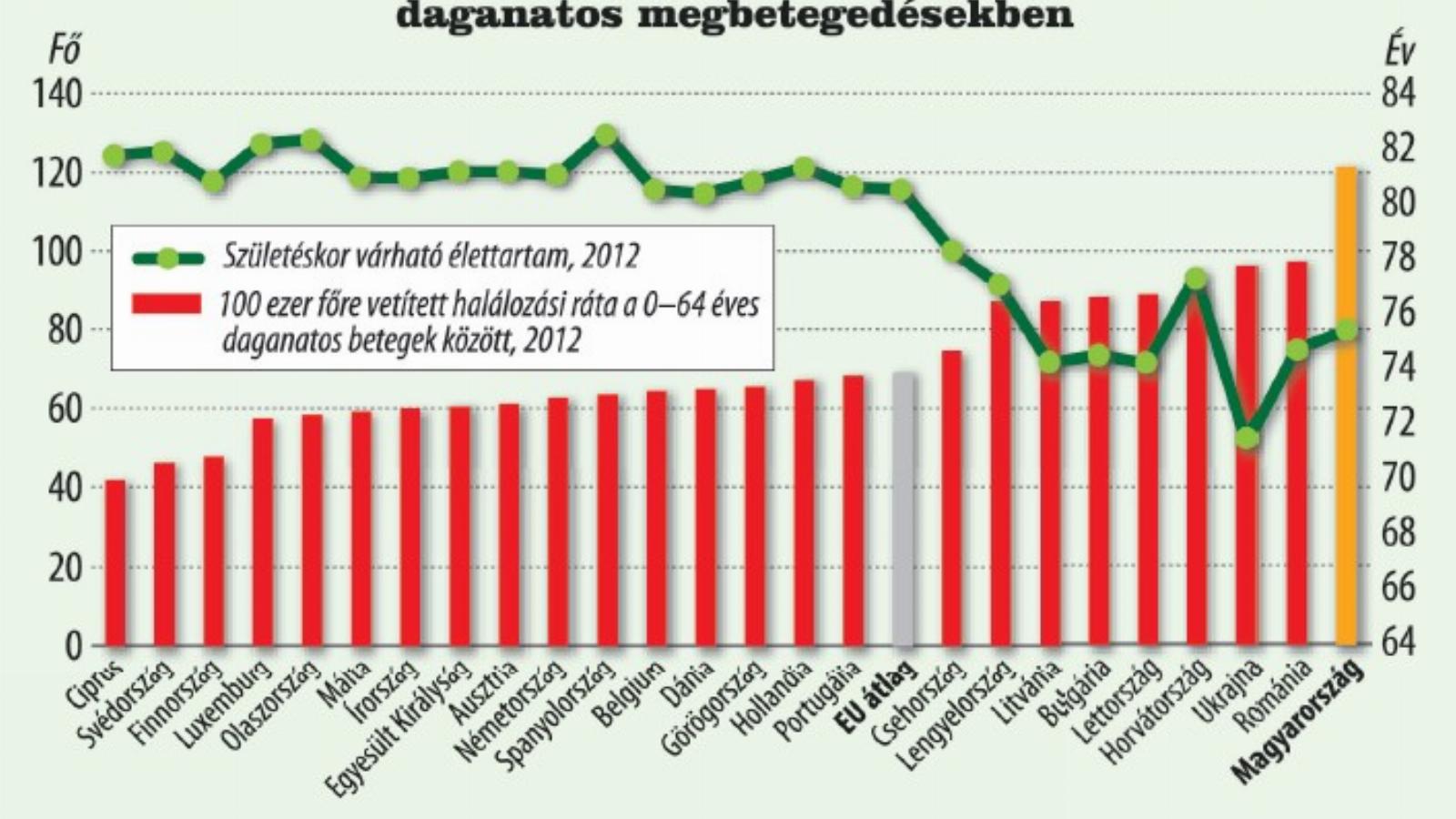
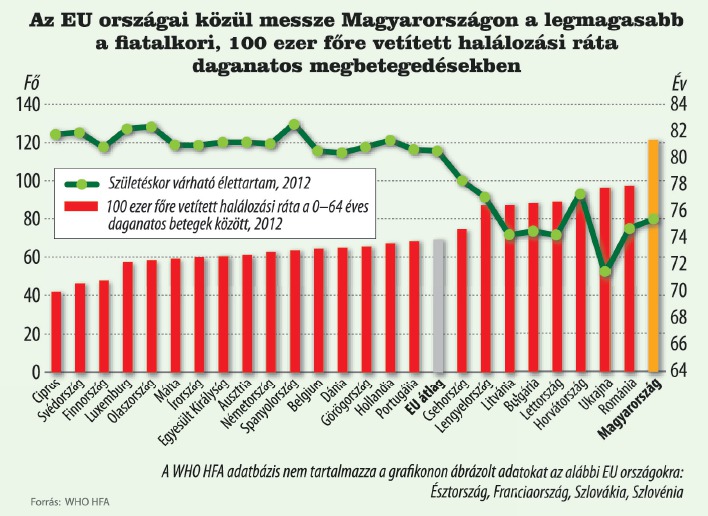
Magyarországon messze a legmagasabb a halálozási ráta a fiatalkori, daganatos megbetegedésekben az Európai Unió tagállamai közül. A Nemzetközi Rákkutatási Ügynökség adatai szerint 100 ezer főre 122 halálozás jut, míg az EU átlag 69. A helyzet nem javul: a KSH 2015-ös jelentése szerint a vizsgált években folyamatosan növekedett a daganatos megbetegedések okozta halálozások száma, amelyek leginkább tüdőrák, vastagbélrák, prosztatarák és mellrák miatt következtek be. Nem túl derűlátóak az ügynökség szakemberei sem: becslésük szerint minden második budapesti lakosnál fognak rákos megbetegedést diagnosztizálni élete során.
Ugyanakkor a világtrend az, hogy a daganatos betegségek kutatási eredményeinek (jobb kezelési lehetőségek, hatékonyabb, célzott gyógyszerek előállítása) köszönhetően folyamatosan javulnak a betegek túlélési esélyei. A túlélés növekedéséhez a különböző innovatív gyógyszerek, kezelési módok is nagyban hozzájárulnak. Az innovatív gyógyszeripari vállalatok folyamatosan kutatják az újabb lehetőségeket, elsősorban a nem, vagy csak nehezen kezelhető betegségeknél alkalmazható korszerű terápiákat, hatékonyabb és biztonságosabb hatóanyagokat igyekeznek kifejleszteni.
Ez évekig, de akár évtizedekig is eltarthat, a kutatás általában a következő szakaszokból áll:
- gyógyszerfejlesztés
- preklinikai fázis
- humánklinikai vizsgálatok
- törzskönyveztetés
A klinikai vizsgálatok szigorú szabályok között működnek, a gyógyszerek hatékonysága és a betegek biztonsága érdekében a törzskönyvezésig eljutott szernek hosszú utat kell bejárnia. A humánklinikai vizsgálatoknak is több fázisa van, az elsőben - amit egészséges önkénteseken végeznek, akik pénzt is kapnak - például azt vizsgálják, hogy az állatkísérletekből átszámolt adagolás milyen hatással van az emberre.
A második fázisban már betegeken próbálják ki az új gyógyszert, akik a vizsgálatot terápiás haszon reményében vállalják. Ebbe a fázisban legtöbbször olyan önkéntes betegek jelentkeznek, akik úgy érzik, már nincs vesztenivalójuk, semmilyen más engedélyezett terápia nem segített rajtuk. A vizsgálatokat csak az Országos Gyógyszerészeti és Élelmezés-egészségügyi Intézet (OGYÉI) által minősített vizsgálóhelyen lehet végezni, jelenleg 17 ilyen van Magyarországon.
Az EU-ban ugyanakkor már arra is van lehetőség 2004 óta, hogy azok a daganatos vagy ritka betegségben szenvedők, akiknél már mindent kipróbáltak, hasztalanul, még az engedélyezés előtt álló gyógyszeres kezelést kapjanak a klinikai vizsgálatokon kívül, az úgynevezett méltányossági kezelés keretében.
A magyar jogszabályok ezt nem tették lehetővé, egészen mostanáig. A kormány tavaly év végén módosította a gyógyszertörvényt, így már a magyar betegek is hozzájuthatnak nem törzskönyvezett orvosságokhoz. Kikötés, hogy az érintett gyógyszer forgalomba hozatali engedélyezési eljárás alatt álljon Magyarországon vagy más olyan országban, ahol a klinikai vizsgálatokra vonatkozó szabályozás egyenértékű a magyar szabályozással, illetve hogy már túl legyenek legalább a második fázisú teszteken.
Ha a beteg hajlandó arra, hogy még nem törzskönyvezett gyógyszerrel történő terápiás kezelésben vegyen részt, a kezelőorvosának kell ezt kérelmeznie az OGYÉI-nél. A gyógyszert annak gyártója biztosítja ingyenesen, így a használathoz még nekik is rá kell bólintaniuk. A kezelőorvosnak pedig nyilatkoznia kell arról, hogy vállalja a kezelést, és meghatározott időnként jelentést kell küldenie az OGYÉI-nek az eredményekről. A gyógyszerhez a gyártó hozzájárulása után 21 nappal már hozzá lehet jutni, indokoltan sürgős esetben azonban három napon belül is dönthet az OGYÉI az engedély megadásáról.
Az így elérhetővé vált új orvosságok újabb esélyt adhatnak a daganatos betegeknek a gyógyulásra, s mivel azok már túljutottak a második fázisú kísérleti vizsgálatokon, a kockázat is csekély. Ám az tagadhatatlan, hogy az említett vizsgálati szakaszban még nem ismert a készítmények minden mellékhatása, így az orvosoknak mérlegelniük kell, hogy a kezelés során várható előnyök felülmúlják-e a kockázatokat. A költségek mellett azonban a lehetséges kockázatok is elsősorban a gyártókat terhelik. Igaz, az OGYÉI tájékoztatása szerint Magyarországon már a klinikai vizsgálatok első fázisában vizsgált gyógyszerek tesztjei is incidens nélkül zajlanak le.